Как преобразуването на химическа енергия в електрическа
Превръщането на химическа енергия в електрическа енергия, свързани с феномена на електролитна дисоциация, същността на което се състои в образуване на заредени частици - йони когато разтваря Neko-toryh вещества (киселини, соли и т.н.).
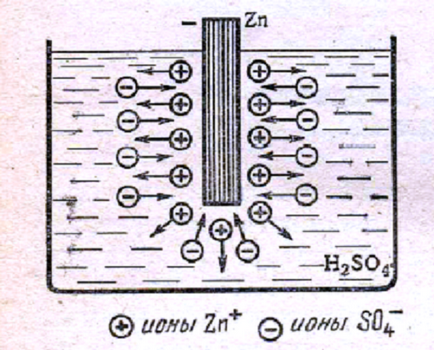
Фигура. 1 Цинк плоча в разтвор на сярна киселина.
Фиг. 1 показва цинков плоча, намалена във воден разтвор на сярна киселина (електролит). Цинкът се разтваря в електро-Lite, разтворът се прехвърля в половите йони бяха Zn +. Разтворът зарежда Xia положителен и цинк - отрицателно-но. цинк разтваряне поради
химични сили.
цинк контактна площ - разтвор електрическо поле произвежда йони насочени от разтягане крадец да цинк.
Тъй като разтварянето на цинк увеличава заряд, а заедно с тях на електрическото поле. Електрическо на ле противодейства преход Zn + йони в разтвора, така че при определено сто-ди- цинк разтваряне спира.
Такова равновесно състояние на съответства на равенството на двете сили, действащи върху йони Zn +: химическата, при което цинкът се разтваря, и електрически предотвратяване на разтваряне. Ръжда-прекратява Ворен цинк в присъствието на потенциал-триал разлика? 1 между цинк и натрий.
Ако същото решение е да се постави плоча от друг материал, описаният процес ще се проведе също в този случай. Но получил Nye потенциална разлика? 2 може да е друга стойност - повече или по-малко? 1.
Съгласно този принцип се формира д. г. а. електрохимичната клетка и батерия (фиг. 2 а, Ь).
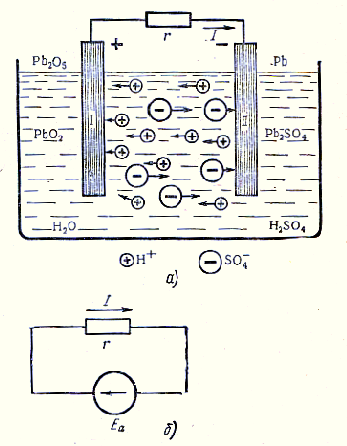
Фигура 2. Зареждане режим води.
Когато се присъедини към плочи I и II в затворен проводник схема ще действа д. г. а. химичен елемент
и електрически ток е установена.
В този случай, д. г. а. Тя е създадена и се поддържа от експлоатация на елемент химични сили (страничната сила), и поради това може да се говори за превръщането на химическа енергия в електрическа енергия.
Електрическият ток в галваничен елемент кал се придружава от необратими електрохимичните процеси, които могат да описват наситен определени химични реакции.
Използването на електрохимични клетки е ограничено - по време, те могат да дадат само nezna-nificant количество електрическа енергия-ТА, и срока на тяхната работа е ниско и завършва, когато активното вещество на електродите до известна степен ще izras-hodovano.
Значително по-заявка зададена имат батерии, електро-химични процеси, които по-обратимо. Обратимостта на електрохимичните процеси, Месечен позволява ПРОВЕРКА ди многократно зареждане и времето ред батерии. Когато зареждането те се натрупват определено количество консумирана химическа енергия поради електрическата енергия, и за изпълнението на тази енергия може да се използва в електрическата верига под формата на електрическа енергия.