Обект оксиди, основни оксиди, киселинни оксиди
основния анхидрид
киселина оксид
Оксиди - комплекс химическо вещество е химическо съединение, прости елементи с кислород. Те са солеобразуваща и не образуват соли. Когато тази сол-образуващи са от 3 вида: Основен ( "база"), киселина и амфотерни.
Примери на оксиди, които не образуват соли, могат да бъдат: NO (азотен оксид) - е безцветен газ, без мирис. Тя се формира по време на буря в атмосферата. CO (въглероден окис) - без мирис газ, произведен по време на изгаряне на въглища. Той обикновено се нарича въглероден окис. Има и други оксиди, които не формират соли. Сега Нека разгледаме по-подробно всеки вид за образуване на соли оксиди.
Основни оксиди - са сложни химически вещества от оксиди, които образуват соли чрез химична реакция с киселини или киселинни оксиди и не реагират с основи или основни оксиди. Например, основните са следните:
К2 О (калиев оксид), СаО (калциев оксид), FeO (железен оксид 2-валентен).
Разглеждане на химичните свойства на оксиди в примерите
1. Взаимодействие с вода:
- взаимодействие с вода за образуване на основа (или алкален)
СаО + Н2 О → Са (ОН) 2 (известен вар гасене реакция, като по този начин, голямо количество топлина!)
2. Взаимодействие с киселини:
- взаимодействие с киселина, за да се образува сол и вода (солена вода)
СаО + H 2SO 4 → CaSO4 + Н2 О (кристали на CaSO4 вещества, известни за всички озаглавено "гипс").
3. Взаимодействие с киселинен оксид: образуване на сол
СаО + → CO2 СаСО3 (Това вещество е известно, че всички - обичайните тебешир!)
Киселинни оксиди - са сложни химически вещества от оксиди, които образуват соли чрез химическо взаимодействие с основи и или основни оксиди не реагира с киселинен оксид.
Примери на киселинни оксиди могат да бъдат:
СО2 (всички известни въглероден диоксид), Р 2О 5 - фосфорен оксид (образувани при изгарянето на въздух на бял фосфор), SO3 - серен триоксид - вещество, използвано за производство на сярна киселина.
- химична реакция с вода
СО2 + Н2 О → Н2 CO3 - вещество - карбонова киселина - един от слаби киселини, неговата добавена газирана вода към "балон" газ. С повишаване на температурата на разтворимостта на газ във вода е намалена, и преминава под формата на мехурчета.
- взаимодействие с основи (бази):
СО2 + 2NaOH → Na2 CO3 + Н2 О-свързани вещества (сол) са широко използвани в домакинството. Нейното име - калцинирана сода или сода за пране - един чудесен препарат за почистване на изгорелите тигани, мазнини, проникване метал. Голи ръце не се препоръчва да се работи!
- взаимодействие с основни оксиди:
СО2 + MgO → MgCO3 - притежават сол - Магнезиев карбонат - Повече нарича "горчив сол".
Амфотерните оксиди - са сложни химикали и свързани оксиди, които образуват соли чрез химическо взаимодействие с киселини (или киселина оксид) и основи (или основни оксиди). Най-честата употреба на думата "аморфно" в този случай се отнася до метални оксиди.
Примери за амфотерни оксиди могат да бъдат:
ZnO - цинков оксид (бял прах, често се използва в медицината за производство на кремове и маски), Al2 О3 - алуминиев окис (също наречен "алуминий").
Химичните свойства на амфотерни оксиди са уникални с това, че те могат да влизат в химични реакции, които съответстват на основи и от киселини. Например:
- взаимодействие с киселинен оксид:
ZnO + Н2 CO3 → ZnCO3 + Н 2О - Полученото вещество - солен разтвор "цинков карбонат" във вода.
- взаимодействие с основи:
ZnO + 2NaOH → Na2 ZnO2 + Н2 О - в резултат вещество - двойна сол на натрий и цинк.
Получаване окиси, получени чрез различни методи. Това може да се случи физични и химични методи. Най-лесният начин е прост химическо взаимодействие на елементите с кислород. Например, резултатът от процеса на горене, или на един от продуктите на тази химическа реакция са оксиди. Например, ако нажежено желязо клонка, а не само желязо (може да цинк Zn, калай Sn, олово олово, мед Cu, - по принцип, което е в ръката) се поставя в колба с кислород, това се случва на химическата реакция на желязо окисление, че То е придружено от ярка светкавица и искри. Реакционният продукт е черен железен оксид прах FeO:
2Fe + О2 → 2FeO
Напълно аналогичен на химични реакции с други метали и неметали. Цинкът се изгаря в кислород, за да се образува цинков оксид
2Zn + О2 → 2ZnO
изгаряне на въглища се придружава от образуване на две оксиди: въглероден окис и въглероден двуокис
2С + О2 → 2CO - образуването на въглероден окис.
C + О2 → CO2 - образуване на въглероден двуокис. Този кислород газ се генерира, ако има повече от достатъчно количество, т.е. във всеки случай първо реакцията протича за образуване на въглероден окис и след това въглероден монооксид се окислява до въглероден диоксид.
Получаване оксиди могат да бъдат изпълнени по друг начин - чрез реакция на химичното разлагане. Например, за да се получи железен оксид или алуминиев оксид, калциниран необходимо да се нагрява съответните основи на тези метали:

Дата на алуминиев оксид - корунд минерална



2AL (ОН) 3 → Al2 3 + 3H2 О,
както и разширяване на отделните киселини:
Н2 CO3 → Н 2О + CO2 - разлагане на карбонова киселина
Н2 SO3 → Н 2О + SO2 - разлагане на сярна киселина
Получаване може да се извърши от оксид метална сол със силна нагряване:
СаСО3 → СаО + CO2 - калциниране на варовик се получава калциев оксид (или негасена вар) и въглероден диоксид.
2Cu (NO3) 2 → 2CuO + 4NO2 + O2 - в тази реакция разлагане се получава само два оксид: мед CuO (черно) и азот NO2 (това се нарича кафяв газ, защото тя не кафяво).
Друг метод, който може да се осъществи получаването на оксиди - редокси реакция
хлорни оксиди

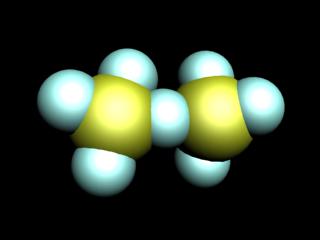
Известни хлорни оксиди. Cl2 О, ClO2. Cl2 О6. Cl2 О7. Всички те, с изключение на Cl2 О7. има жълт или оранжев цвят и не са стабилни, особено ClO2. Cl2 О6. Всички експлозивни и хлорни оксиди са много силни окислители.
По този начин, Cl2 О - киселинен оксид хлор хипохлориста киселина.
Cl2 О + Н 2О → 2HClO - Хипохлористата киселина
ClO2 - оксид хлор хипохлориста киселина и хлорна киселина, като химична реакция с вода образува само две от тези киселини:
Cl2 О6 - твърде киселинен оксид хлор хлорна и перхлорна киселина:
Накрая, Cl2 О7 - безцветна течност - киселинен оксид хлор перхлорна киселина:
азотни оксиди
Азот - газ, който образува 5 различни съединения с кислород - 5 азотни оксиди. А именно:
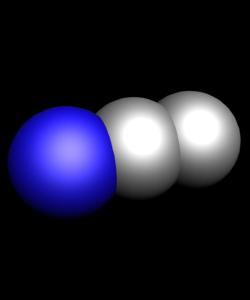
- N2 О - азотен оксид. Другото му име е известно в медицината нарича райски газ, или азотен окис - безцветен, сладък и приятен на вкус газа.
- NO - азотен оксид - безцветен, като нито миризма нито вкус газ.
- 2O 3 - азотен анхидрид - безцветно кристално вещество
- NO2 - азотен диоксид. Другото му име - кафяв газ - газ, всъщност има кафяво-кафяв
- 2O 5 - азот анхидрид - син течност, кипяща при температура от 0 ° С 3.5
От всички тези изброени азотни съединения с най-голям интерес в индустрията са NO - и азотен оксид NO2 - азотен диоксид. Азотен оксид (NO) и азотен оксид N2 О не реагира нито с вода или с основи. Азотен двуокис (2O 3) в реакцията с вода образува слаба и нестабилна HNO2 с азотиста киселина. че въздухът постепенно се превръща в по-стабилна химически азотна киселина разгледаме някои от химичните свойства на азотен оксид:
Реакция с вода:
2NO2 + Н2 О → HNO3 + HNO2 - 2 Веднага се образува киселини: HNO3 азотна киселина и азотна киселина.
Реакция с алкален:
2NO2 + 2NaOH → NaNO3 + NaNO 2 + Н 2О - форма две соли: натриев нитрат NaNO3 (или натриев нитрат) и натриев нитрит (сол азотиста киселина).
Реакцията на соли:
2NO2 + Na2 CO3 → NaNO3 + NaNO2 + CO2 - образува форма две соли: натриев нитрат и натриев нитрит, и произвежда въглероден диоксид.
Готови азотен диоксид (NO2) от азотен монооксид (NO) чрез химическа реакция с кислород съединение в:
железни оксиди
Железен оксид формира две. FeO - железен оксид (2-валентен) - черен прах, който се получава чрез намаляване на железен оксид (3-валентна) с въглероден монооксид в съответствие със следната химична реакция:
Този основен оксид лесно реагира с киселина. Това е намаляване свойства и бързо се окислява в железен оксид (3-валентна).
Железен оксид (3-валентна) - червено-кафяв прах (хематит) с амфотерни свойства (и може да реагира с киселини и основи). Въпреки това, киселинни свойства на оксид са изразени толкова слаб, че най-често се използва като основен оксид.
Налице е така наречената смесена железен оксид Fe3 O4. Тя се формира по време на горенето на желязо, добър проводник на електричество и има магнитни свойства (наречен магнетит или магнетит). Ако желязо се изгаря, реакцията получената горене произвежда шлака, състояща се от две оксиди: железен оксид (III) и (II) валентност.
серен оксид

Серен оксид SO2 - или серен диоксид се отнася до киселинни окиси. но не образува киселина, въпреки че напълно разтворим във вода - 40L серен оксид в 1 литър вода (за улесняване на изготвянето на химически разтвор от уравнения наречени серниста киселина).
При нормални обстоятелства - е безцветен газ с остър и задушава мирис на сяра. При температура от -10 0 ° С в цялата си възможно прехвърляне в течно състояние.
В присъствието на катализатор -vanadium оксид (V2 О5) серен оксид добавя кислород и се превръща в серен триоксид
серен диоксид се разтваря във вода - SO2 серен оксид - много бавно окислява, при което се разтворът се превръща в сярна киселина
Ако серен диоксид се пропуска през разтвор на основа, например, натриев хидроксид, след това образуваната натриев сулфит (или бисулфит - в зависимост колко да алкален и серен диоксид)
NaOH + SO2 → NaHSO3 - серен диоксид се разтваря в излишък
Ако серен двуокис не реагира с вода, поради своята воден разтвор дава кисела реакция. Да, това не реагира, но той се окислява във водата, от съюзяването на себе си кислорода. И се оказва, че водата натрупаните свободни водородни атоми, които дават кисела реакция (можете да проверите известна представа!)
Превключи на английски
Свойства на оксиди
Основни и кисели окиси