Оксиди на класификация, получаването и химични свойства
Оксиди - са комплексни вещества, съставени от атоми от два елемента, единият от които - кислород в степента на окисление -2. Където кислород е свързан само с малко електроотрицателна елемент.
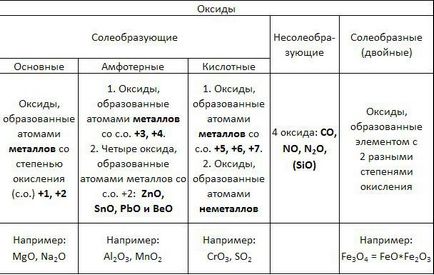
В зависимост от втория елемент оксиди проявяват различни химични свойства. оксиди училищния курс по традиция се разделят на сол, образуващи и nesoleobrazuyuschie. Някои оксиди са посочени като сол като (двойно).
Двойни оксиди - някои оксиди. елемент, образувани с различни степени на окисление.
Солеобразуващи оксиди са разделени на основни, киселина и амфотерни.
Основни оксиди - това оксиди като основни свойства характеристика. Те включват окиси, образувани от метални атоми с номер окисление на 1 и 2.
Киселинни оксиди - оксиди се характеризира киселинни свойства. Те включват оксиди оформени метални атоми в окисление 5, 6 и 7, и неметални атоми.
Амфотерните оксиди - оксиди се характеризира с двете основни и киселинни свойства. Тези метални оксиди в степента на окисление 3 и 4, и четири оксид окисление 2: ZnO, PbO, SnO и ВеО.
Nesoleobrazuyuschie оксиди не показват характерните основни или киселинни свойства, те не отговарят хидроксиди. За провеждане четири nesoleobrazuyuschim оксид: CO, NO, N2 О и силикагел.
класификация на оксиди
Получаване оксиди
Общи методи за получаване на оксиди:
1. Взаимодействие на прости вещества с кислород:
1.1.Okislenie метали. 4Al + 3O2 = 2Al2 3 (изключения не се окисляват с кислород въздух, злато, платина, паладий, натриев чрез окисляване с атмосферен кислород главно форми пероксид Na2 O2 калий, цезий, рубидий пероксиди MeO2 предпочитане образуват състава.).
Забележки: метали с променлива окисляване окислени от атмосферен кислород, като правило, до състояние на междинно окисление (3):
2. Окисляване на комплексни вещества (съединения) двоични сулфиди, хидриди, фосфиди, и т.н.
В окисляване с кислород комплексни вещества, състоящи се обикновено от два елемента, смес от оксиди на тези елементи в стабилни на окисление. Например, изгарянето на пирит FeS2, смес от железен оксид (III) и серен оксид (IV):
3. Разширяване на хидроксиди. Оксиди могат да бъдат получени от хидроксиди - киселини или основи. Някои хидроксиди са нестабилни и се разлагат в спонтанно оксид и вода; разлагане на друг (обикновено неразтворими във вода) е необходимо да ги нагрее хидроксиди (калциниран).
Разпадане спонтанно във воден разтвор, карбонова киселина, сярна киселина, амониев хидроксид, хидроксиди на сребърен (I), меден (I):
При нагряване се разлагат до неразтворими оксиди, хидроксиди, най - силициева киселина, хидроксиди на тежки метали - железен хидроксид (III) и др.:
4. Друг метод за получаване на оксиди - разлагане на комплексните съединения - соли. Най-неразтворими соли и някои разтворими при нагряване се разлагат без да се променя състоянието на окисляване оксиди:
Соли, образувани със силни киселини, антиоксиданти (. Нитрати, сулфати, перхлорати, и т.н.), при нагряване, са склонни да се разлага със степента на окисление:
Химичните свойства на оксиди
Голяма част от химичните свойства на оксиди описано схема за взаимно свързване основни класа на неорганични съединения.
Химичните свойства на основни оксиди
Повече информация за химичните свойства на основните оксиди може да се прочете тук.
Химичните свойства на киселинен оксид.